
近日,我室王陈继青年副研究员带领的研究小组与美国梅奥医学中心(Mayo Clinic)黄浩杰教授和第二军医大学孙颖浩院士的研究团队合作,在国际顶级生物医学期刊〈自然.医学〉(Nature Medicine)(IF=29.886)杂志,在线发表题为《前列腺癌中由SPOP基因突变导致BET蛋白稳定及AKT-mTORC1信号通路激活介导的BET抑制剂天然耐药》 (Intrinsic BET inhibitor resistance in SPOP-mutated prostate cancer is mediated by BET protein stabilization and AKT–mTORC1 activation)的研究论文,在前列腺癌精准医学领域取得重要研究成果。

1. (卡通:源自《一千零一夜》里面的《渔夫和魔鬼》的故事,SPOP失活(瓶子封印被破坏)导致BET蛋白大量积累(魔鬼释放)促进了肿瘤细胞的恶性增殖和对BET抑制剂JQ1的耐药)
前列腺癌是目前全世界男性第二大癌症,每年造成超过25万人死亡。我国前列腺癌的发病率虽低于西方国家,但随着社会老龄化、人口城市化、膳食结构西方化,前列腺癌发病率呈显著增长趋势,已位列我国男性癌症发病率的第六位,对人们的生命健康构成严重威胁。目前,常规手术治疗、内分泌及化学药物疗法已进入发展平台期,难以进一步提高疗效,寻找治疗前列腺癌的新方法迫在眉睫。前列腺癌发生发展的遗传因素复杂多样,存在显著的肿瘤异质性,不同患者的肿瘤在基因组序列、表观遗传学等分子水平上存在巨大差异。这种差异直接导致了即使相同病理类型的前列腺癌患者,对治疗药物的反应(耐药性)也不尽相同。随着高通量测序技术的快速发展,前列腺癌的“精准治疗”初露曙光。技术进步使我们能够对肿瘤的整个基因组的遗传变异进行精确分析,测序成本的迅速下降也使得测序技术能够为普通患者准确判读体内独有的基因突变情况。但是目前对肿瘤基因组遗传变异的意义解读和寻找相应的分子靶向治疗手段仍然十分艰巨。
前列腺癌基因组的大样本测序研究发现,四分之三的前列腺癌可根据其关键癌/抑癌基因的突变分为七个分子亚型,包括ETS家族基因融合(ERG、ETV1、ETV4或FLI1),SPOP、FOXA1和IDH1基因点突变。另有四分之一的前列腺癌是由其他未知的遗传改变驱动。该项研究聚焦于SPOP突变的前列腺癌分子亚型。SPOP是一个介导蛋白质泛素化修饰的E3泛素连接酶亚基,目前对其生物学功能知之甚少。2012年SPOP被首次发现在大约10%的前列腺癌样本中发生点突变。这一亚型肿瘤通常伴有CHD1基因缺失、雄激素受体活性上升和基因组DNA甲基化水平较高等分子特征。然而SPOP突变是如何导致前列腺癌?对该亚型前列腺癌有没有好的分子靶向治疗策略? 这些问题亟待解决。
BET蛋白(BRD2、3和4)是一类可以和乙酰化组蛋白结合的表观遗传学调控蛋白,它控制了C-Myc、PIM1和BCL2等促生长、抗凋亡靶基因的转录。BET蛋白是目前以表观遗传蛋白为靶点的抗肿瘤药物设计的“明星分子”。BET小分子抑制剂如JQ1、iBET对多种肿瘤细胞表现出极佳的杀伤效果,目前已在前列腺癌中开展一期临床试验。该研究首次发现BET蛋白是SPOP的作用底物。正常细胞中SPOP通过蛋白酶体途径促进BET蛋白的泛素化降解,将BET蛋白维持在较低水平。SPOP突变导致其与BET蛋白的相互作用及其促进BET蛋白泛素化降解的能力大为降低,BET蛋白在肿瘤组织中大量积累。BET蛋白积累促进了胆固醇合成相关代谢酶类(如FDFT1, DHCR24等)和小GTP酶 Rac1的转录,进而激活AKT-mTORC1信号通路,促进肿瘤细胞的恶性增殖。有趣的是,肿瘤中SPOP突变导致的BET蛋白大量积累,使得BET抑制剂对前列腺癌细胞的杀伤作用大为减弱。但是BET抑制剂和AKT抑制剂联用的话,则又可以恢复前列腺癌细胞对BET抑制剂的敏感性。该项研究的意义在于:部分阐明了SPOP突变促进肿瘤恶性增殖的分子机制,同时揭示了SPOP突变亚型前列腺癌对BET抑制剂存在天然耐药现象。单独BET抑制剂对这一亚型肿瘤的治疗效果可能不佳,但可以考虑和AKT抑制剂联合使用的方案,能有效逆转BET抑制剂耐药。这些信息为该亚型前列腺癌的精准治疗提供了理论指导。
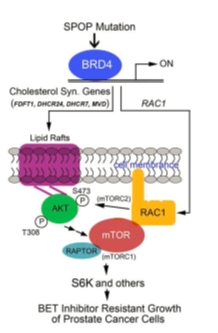
2. 前列腺癌SPOP突变促进BET抑制剂耐药的模式图
王陈继副研究员、黄浩杰教授和孙颖浩院士为本文的共同通讯作者。复旦大学章平肇副研究员和高昆博士后、Mayo Clinic王德解博士和赵瑜博士、第二军医大学任善成副教授为本文的共同第一作者。该研究得到精准医学国家重大研究计划和国家自然科学基金的资助。
王陈继副研究员近年来在前列腺癌SPOP基因突变的致癌分子机制研究方面取得了一系列重要研究成果,已在PLOS Genetics、Cell Reports、Cell Death&Disease、Human Mutation等国际学术期刊发表多篇论文。