
N6-methyladenosine(m6A)是真核生物mRNA上含量最丰富的化学修饰之一,由甲基转移酶复合物(Writer)所添加,主要被含有YTH结构域的Reader识别,并且可以被FTO和ALKBH5等Eraser去除。m6A甲基转移酶复合物由进化中保守的7个成员构成,包括催化组分Mettl3,以及Mettl14, WTAP (Fl(2)d), VIRMA (Vir), RBM15 (Nito), ZC3H13 (Xio or Flacc)和Hakai,其中Hakai作为一个潜在的RING finger E3泛素连接酶是研究最少的。
严冬课题组前期筛选和鉴定了m6A甲基转移酶复合物和果蝇性别决定通路两个新的组分Nito(PNAS, 2015)和Xio(也称为Flacc)(PNAS, 2018),并参与了果蝇m6A修饰通路的整体解析。2021年4月12日,在Nature Communications杂志上发表题为“Role of Hakai in m6A modification pathway in Drosophila”的文章。本文是作者m6A甲基转移酶复合物研究三部曲之一,证明了Hakai是m6A 修饰通路核心成员之一,解析了它及其它成员的作用机制,并发现了性别特异性的m6A修饰方式。
首先,作者验证了Hakai与其他m6A writer组分存在相互作用,并且Hakai突变体果蝇表现出特征性的m6A通路表型,例如mRNA中的m6A修饰水平降低,Sxl(Sex lethal)及其它基因的可变剪接出现异常,成虫翅膀姿势异常和不能飞行,以及在MeRIP-seq实验中减少的m6A峰与Mettl3和Mettl14突变体相一致。这些数据清楚表明Hakai是保守的m6A甲基转移酶复合物的核心组分之一。
随后,作者对m6A writer多个组分的作用机理进行了较为系统的研究,发现Fl(2)d, Vir, Hakai和Flacc形成稳定的复合物,敲除Fl(2)d, Vir或Hakai导致其它三个组分的降解,但是Mettl3, Mettl14和Nito不受其影响。敲除Flacc导致Fl(2)d的细胞核染色减少,与之前细胞系中报导的结果相一致。基于这些结果,作者提出了m6A甲基转移酶复合物的工作模型(图1)。

图1. m6A甲基转移酶复合物
Hakai最初在人类细胞中被鉴定出来,它与钙粘蛋白(E-cadherin)相互结合并导致其泛素化,从而促进E-cadherin的内吞和降解。但是,作者使用多种遗传工具进行的体内分析未发现Hakai在E-cadherin调节中的作用。并且Hakai是一种普遍存在的核蛋白,几乎与膜上的E-cadherin没有共定位。因此,这一模型需要使用基因敲除小鼠进行进一步解析,此外还需要寻找Hakai作为潜在E3连接酶的底物。
通过在野生型成虫以及Mettl3,Mettl14和Hakai突变体中进行MeRIP-seq,发现尽管大多数m6A修饰峰分布在3'UTR中,但在m6A writer突变体中下降的峰则主要是位于5'UTR中。而在哺乳动物中,m6A峰则主要富集在3'UTR和终止密码子附近。3'UTR中的m6A修饰通常会导致mRNA的不稳定,而5'UTR中的m6A与翻译增强有关。作者没有观察到与野生型相比,Mettl3突变体中m6A靶标的mRNA半衰期增加,暗示m6A修饰在果蝇中的主要作用不是在mRNA降解上。
该文中最有趣的发现可能是展示了围绕Sxl关键外显子的雌性特异性m6A修饰。Sxl是教科书上关于可变剪接的经典范例:雄性剪接形式包含外显子3,该外显子含有终止密码子并导致Sxl蛋白翻译的早期终止;而雌性剪接形式则跳过外显子3并因此产生功能性的Sxl蛋白。最近,m6A修饰途径被证明调控Sxl的可变剪接,但是m6A修饰与Sxl蛋白协同调节其自身剪接的详细机制仍不清楚。作者MeRIP-seq数据显示,只有在雌性中,Sxl外显子3及其周围存在m6A修饰,并且位于Sxl结合位点附近(图2)。m6A-IP-qPCR进一步验证了这一发现,并表明这些修饰在Mettl3突变体雌性果蝇中下降。这一出乎意料的发现提示了一种模型,即Sxl的一个主要功能可能是招募m6A writer复合体从而甲基化附近的m6A位点。m6A reader Ythdc1然后结合到这些位点,并可能与剪接机器相互作用以抑制剪接。
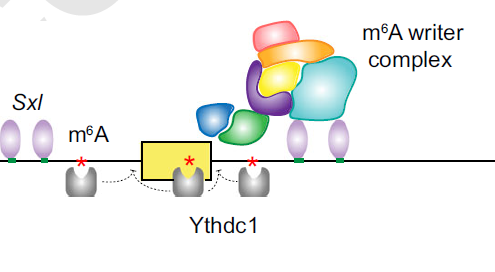
图2. Sxl与m6A修饰共同调控其可变剪接的模型