
腓骨肌萎缩症(Charcot-Marie-Tooth, CMT)是最常见的可遗传性外周神经退行性疾病,发病概率为 1/2500,导致运动相关神经的阶段性退化,例如肌肉萎缩、肌无力及手脚发育畸形等。氨酰 t-RNA 合成酶家族中的甘氨酸-tRNA 合成酶(GlyRS)的基因(GARS) 的突变是导致 CMT2D(2D subtype of CMT)的重要病因,但背后的机制尚未完全阐明。
2021 年 5 月 30 日,我室余巍课题组在 Aging Cell 在线发表文章 SIRT2- knockdown Rescues GARS-induced Charcot-Marie-Tooth Neuropathy,发现敲低衰老基因 SIRT2 可以挽救 GARS 突变诱导的 CMT 疾病。

外周神经系统轴突运输需要一个组织良好的微管网络来有效地在突触和体细胞之间运输囊泡,而微管中微管蛋白的乙酰化是稳定性微管的标志,最近研究发现a-tubulin 的乙酰化可以保护微管免受机械损伤,促进分子运动驱动蛋白的锚定,并刺激微管的囊泡运输。因此,微管蛋白的乙酰化在维持正常的外周神经轴突运输功能上发挥重要作用。 SIRT2 属于 III 类 HDAC 家族,是主要的a-Tubulin 的去乙酰化酶,在调节轴突运输的过 程扮演着至关重要的角色。
余巍课题组发现,野生型 GARS 可以结合去乙酰化酶 SIRT2,抑制其活性,维持了 SIRT2 的主要底物a-tubulin 的乙酰化。而 GARCMT 突变体显著降低了与 SIRT2 的结合, 导致乙酰化微管蛋白的显著下降,这可能是导致 CMT 等神经病变的原因。用 GARS 截断体和 SIRT2 进行互作分析,发现 GARS 的催化结构域与 SIRT2 相互作用,这是 CMT2D 最多的突变定位。这些结果提示,GARS 中 CMT2D 突变可能改变其结构构象,使 GARSCMT 失去与 SIRT2 的结合,减少对 SIRT2 酶活的抑制,从而显著降低乙酰化a-tubulin。进一步利用果蝇作为模式生物,敲低 SIRT2 能显著拯救 GARSCMT 运动方面的表型,并延长 GARSCMT 果蝇的寿命;而用 SIRT2 特异性抑制剂处理 GARSCMT 果蝇,也能拯救 GARSCMT 果蝇运动性能的缺陷和寿命。本研究提供了一种潜在的靶向 SIRT2 而拯救 GARS 突变导致腓骨肌萎缩症的方法, 为治疗遗传性外周神经疾病提供了新的可能性。
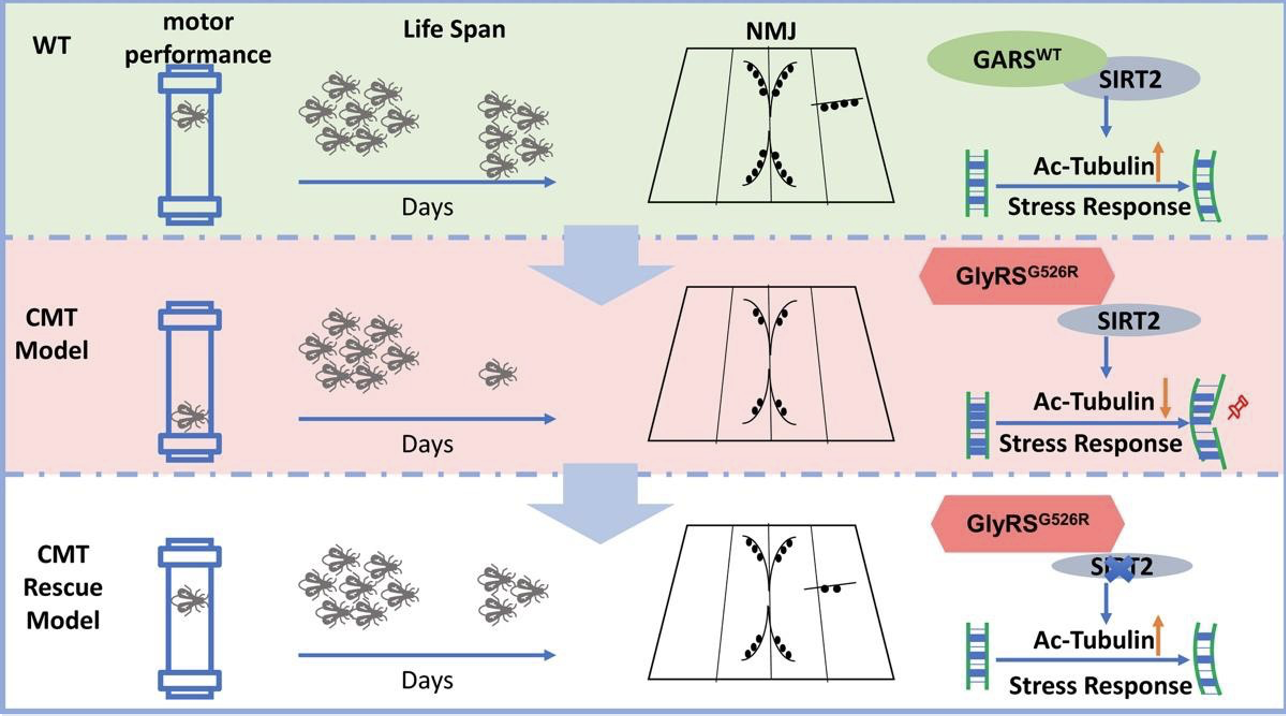
图示:靶向 SIRT2 作为乙酰化微管蛋白和 CMT 神经病变之间关键节点的示意图
复旦大学研究生赵颖颖,谢良国,沈潮为本文共同第一作者,复旦大学余巍研究员 为通讯作者,本课题得到复旦大学林鑫华,戚昀,闫致强,林金钟,周德健和西南医科 大学代荣阳、邢娟的大力帮助。本研究得到基金委、科技部和复旦大学相关基金的支持。