
非酒精性脂肪性肝炎(Nonalcoholic Steatohepatitis,NASH)是非酒精性脂肪性肝病(Nonalcoholic Fatty Liver Disease,NAFLD)进展而来的严重慢性肝脏疾病。流行病学数据显示,15%-25%的NAFLD患者最终会发展为NASH,NASH可继续发展为肝硬化和肝细胞癌。已有报道,运动会通过降低胰岛素抵抗,调控游离脂肪酸的从头合成,改善肝脏代谢,而不依赖于体重的减轻。骨骼肌作为内分泌器官,越来越多的证据表明,骨骼肌可以分泌各种影响其他代谢组织(包括肝组织)的肌肉因子。虽然一些肌肉因子(如白细胞介素-6、肌肉生长抑制素和激活素)已被发现在肝脏脂肪变性、纤维化和癌症中起关键作用,其他肌肉因子在对肝脏的调控作用还有待全面研究。
IRF4(Interferon regulatory factor 4,IRF4)作为干扰素调节因子家族的一员,因其在免疫细胞发育和功能中的调节作用而闻名。孔星星教授前期研究结果发现棕色脂肪组织中(BAT)的IRF4能与PGC-1α直接相互作用、促进UCP1的表达和热量生成,此外,还通过分泌蛋白Myostatin调控骨骼肌功能(Cell Metabolism丨孔星星、刘铁民等合作揭示棕色脂肪调控骨骼肌的新机制)。最近,孔星星教授团队研究发现(Adv Sci丨孔星星/刘铁民/李仲合作组揭示骨骼肌IRF4通过PTG/糖原途径调节运动能力),骨骼肌特异性IRF4敲除(F4MKO)小鼠给与高脂饮食后小鼠表现出抵抗肥胖,胰岛素敏感性的增加和运动能力的增强。考虑到骨骼肌胰岛素抵抗与老年人肝脏脂肪从头合成和肝脂肪变性增加有关,骨骼肌IRF4敲除是否会影响肝脏代谢还需要进一步的研究。
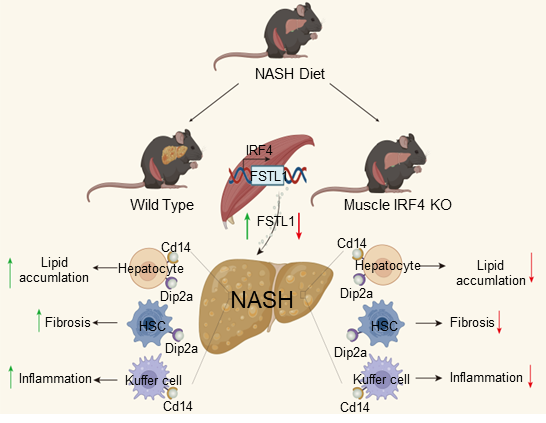
近日,我室孔星星/高焕庆/刘铁民团队在Nature Communications杂志上合作发表了一篇题为Metabolic crosstalk between skeletal muscle cells and liver through IRF4-FSTL1 in nonalcoholic steatohepatitis的论文,该研究指出骨骼肌特异性敲除IRF4,给与NASH饮食后,表现出肝脏病理表型的改善。并发现F4MKO小鼠肌肉来源的FSTL1参与了IRF4介导了NASH进展。FSTL1进一步通过DIP2A和CD14受体调控肝脏脂代谢、降低炎症和纤维化,阐释了骨骼肌IRF4通过FSTL1-DIP2A/CD14通路在NASH发病机制发挥的关键作用。

作者通过骨骼肌特异性敲除和过表达策略展开相关研究,发现:F4MKO小鼠给与NASH饮食后,肝脏脂质堆积减少,炎症水平降低,纤维化得到改善,同时体重无显著变化。在F4MKO小鼠骨骼肌特异性过表达FSTL1后,其肝脏脂质堆积、炎症水平和纤维化均恢复到对照组水平。
FSTL1具有多种功能,可以通过不同受体激活各种信号通路。已有研究报道FSTL1与受体Dip2a结合,通过Smad2/3信号通路调节血管生成【7】。但目前尚不清楚FSTL1介导的脂质代谢、炎症反应和纤维化需要哪些受体。本研究通过蛋白质组学、双荧光素酶和FSTL1回补实验证实FSTL1作为一种肌肉因子在肝脏中介导IRF4功能。细胞共培养实验结果显示,Dip2a和Cd14可能是肝脏中FSTL1的受体,介导其功能。此外,为了进一步在体内验证这些结果,本研究在骨骼肌特异性过表达FSTL1的F4MKO小鼠,使用腺相关病毒直接阻断肝脏中Dip2a和Cd14的表达。当Dip2a和Cd14在肝脏中被敲低时,FSTL1不能恢复肝脏脂质堆积、炎症反应和纤维化表型。
本研究观察到血清FSTL1水平与人类NASH进展呈正相关。综上所述,骨骼肌IRF4转录调节FSTL1,肌肉源性的FSTL1在肝脏分泌,通过DIP2A/CD14通路介导NASH进程。靶向这一信号通路可能是NASH管理中一种有吸引力的策略。
复旦大学生命科学学院博士后郭珊珊、复旦大学附属华山医院内分泌科博士生冯永浩、复旦大学附属中山医院内科基地住院医师朱小鹏、复旦大学人类表型组研究院博士生张昕熠为该论文共同第一作者。我室孔星星教授,高焕庆青年副研究员,刘铁民教授和复旦大学附属中山医院内分泌科卞华主任医师为该论文共同通讯作者。
孔星星课题组和刘铁民课题组主要研究周边器官和神经比如脂肪、肌肉和肝脏等在调节能量代谢/糖脂代谢中的重要作用。实验室长期招聘优秀博士后,欢迎有神经生物学/生物化学与分子生物学/生理学/细胞生物学/免疫等研究背景,有志从事代谢性疾病机制研究的博士加盟实验室。
原文链接:
https://www.nature.com/articles/s41467-023-41832-3